BAĞLAŞIK ÖZELLİKLER
(Colligative Properties)

Bağlaşık özellikler (kolligatif özellikler) kimya alanında kullanılan bir sözcüktür. Bir maddenin yapısındaki parçacıkların (moleküller veya atomlar) sayısına bağlı olan ya da bu sayıyla birlikte değişen ama parçacıkların niteliğine bağlı olmayan özelliğe verilen tanımlamadır. Bağlaşık özellikler
Çözeltilerdeki bağlaşık özellikler, çözünen moleküllerin veya iyonların konsantrasyonuna bağlı olan ancak çözünen maddenin kimliğine bağlı olmayan özelliklerdir.
Bağlaşık özellikler, buhar basıncını düşürme, kaynama noktası yükselmesi, donma noktası alçalması ve ozmotik basıncı içerir.
İdeal bir gazın basıncı ve bir çözücünün donma noktasının, bu çözücüde çözünmüş parçacıklara bağlı olarak düşmesi bağlaşık özelliğe verilebilecek örneklerdendir.
Buhar Basıncını Düşürmek
Önce kendimize buhar basıncının ne olduğunu ve onu kimyasal ve fiziksel olarak neyin etkilediğini hatırlatalım. Kapalı bir kapta, sıvı, gaz fazına kaçarken eşit miktarda molekül sıvı haline dönene kadar buharlaşacaktır. Buhar fazının bu noktada sıvının üzerindeki basıncına denge buhar basıncı denir. Bu buhar basıncı, sistemin sıcaklığı da dahil olmak üzere bir dizi faktöre bağlıdır (moleküllerin gaz fazına kaçmasına yardımcı olmak için kinetik enerji gereklidir), sistemin basıncı (yüksek basınç sıvıdaki gazı tutabilir, örn. bir şişe kola) ve ayrıca sıvının moleküller arası kuvvetleri (daha güçlü bağlar, buharlaşma sürecini yavaşlatmak için sistemin genel buhar basıncını düşürmek için daha fazla kinetik enerji gerektirecektir).
Söz konusu çözücüye bir çözünen madde eklersek sisteme ne olur? En basit terimlerle, çözünen moleküllerin bazıları sıvının yüzeyinde boşluklar alacağından, yüzeydeki çözücü moleküllerin sayısını sınırlayacaktır.
Sadece yüzeyde bulunan çözücü molekülleri kaçabildiğinden (buharlaşabildiğinden), çözünen maddenin saf varlığı, gelen ve giden çözücü moleküllerinin sayısını azaltır ve dolayısıyla denge buhar basıncını düşürür.
Çözünmüş maddenin buhar basıncını ne kadar etkilediğini anlamak için, sıvının yüzeyine kaç tane daha molekülün ulaşabildiğini tahmin etmemiz gerekir.
Çözücüye karşı çözücünün kaç molekül olduğuna iyi bir yaklaşım, mol fraksiyonu, Xçözücüsüdür .
Eğer basitçe çoklu standart buhar basıncı ile çözücünün yeni mol fraksiyonu (poçözücü) saf çözücünün, bu bize çözücünün yeni buhar basıncına çok yakın bir değer verecektir.
Denklem Pçözücü = Xçözücü Poçözücü gibi görünecektir Bu denkleme Raoult Kanunu denir. Bu denklemden elde ettiğiniz basıncın, çözünen madde ile birlikte sistemin yeni denge buhar basıncı olduğunu unutmayın.
Ne kadar değişikliğin gerçekleştiğini bilmek istiyorsanız, yeni Pçözücü ile saf çözücünün asıl Poçözücü arasındaki farka bakmak gerekecektir (başka bir deyişle birini diğerinden çıkarma). DP = Pçözücü – Poçözücü = sisteminin buhar basıncındaki değişim. Hemen hemen tüm uçucu olmayan çözücüler için bu değişiklik negatif bir değer olacaktır.
Raoult Yasasında Sınırlamalar
Raoult yasası sadece düşük konsantrasyonlu çözeltiler için geçerlidir. Yaklaşımımızın çalışması için, çözünen ve çözücü molekülleri arasındaki etkileşimler neredeyse aynı olmalıdır. Etkileşimler daha güçlü ise, çözücünün buharlaşma ısısı değişecektir ve bu nedenle tüm yaklaşımımız dağılmaktadır. Moleküller arası kuvvetlerin moleküller arasında büyük ölçüde değiştiğini bildiğimiz için, çözünmüş madde konsantrasyonunu düşük tutarak bu kuvvetlerin etkisi minimumda tutulmalıdır. Bunu bir oda dolusu 1000 kişilik bir partide kokmuş bir adam olarak düşünebilirsiniz, onu koklamak zorunda kalmamanız için çok iyi bir şans var, ancak odada 100 kokmuş adam olsaydı, tüm parti mahvolurdu!
Bir diğer husus çözünen çeşididir. Çözünen madde bir iyonik tür (bir tuz) ise, büyük olasılıkla çözücüye (normalde su) çarptığında bileşen iyonlarına ayrılır. Bu durumda, oluşan her parçacığı dikkate almamız gerekir. Örneğin, bir çözeltiye 0.25 mol NaCl eklediyseniz, 0.50 mol iyonun toplam kolligatif etkisi için aslında 0.25 mol Na+ ve 0.25 mol Cl– eklersiniz.
Bu 2 x 0.25 değerine van’t Hoff faktörü ( i ) denir ve iyon içeren çözeltilerin bağlaşık özelliklerini her hesapladığınızda kullanılmalıdır.
Kaynama Noktası Yüksekliği
Bir çözücüye çözünen ilavesinin buhar basıncını nasıl azaltabildiğini gördüğümüze göre, bunun aynı çözücünün kaynama noktasıyla nasıl ilişkili olduğunu anlayabilelim. Bir sıvının normal kaynama noktası, sıvının buhar basıncının standart basınca (1 atm) eşit olduğu sıcaklık olarak tanımlanır. Harici basıncı 1 atm daha düşük veya daha yüksek olarak değiştirirsek, kaynama noktası da değişir. Daha sonra kaynama noktası, çözücünün buhar basıncının çevrenin basıncına eşit olduğu sıcaklıktır. Buhar basıncı bu noktaya ulaşıncaya kadar, gaz molekülleri kaçamaz, yüzeydeki basınç onları tutar. Kaynama noktası sıcaklığına ulaştığınızda, buhar basıncı daha sonra harici basınca eşittir ve moleküller kaçabilir. Sıvıyı tamamen buharlaştırmak için gerçekten kaynama noktası sıcaklığını aşmanız gerektiğini unutmayın. Yani buhar 100o C’den daha sıcaktır.
Şimdi bağlaşık özelliklere geri dönelim… bir çözücüye çözünen madde eklemek kaynama noktasını nasıl etkiler? Şimdi, sıvının yüzeyinde pozisyon alan çözünen moleküllerin buhar basıncını baskılayacağını anlıyoruz. Ayrıca, kaynama noktasına ulaşmak için sıvının buhar basıncını yükseltmemiz gerektiğini de biliyoruz, bu da aynı buhar basıncına ulaşmak için daha fazla enerji girmemiz gerektiği anlamına gelmelidir. Daha fazla enerji girişi, bu tip sistemdeki ısı girişine eşittir, bu nedenle aynı buhar basıncını elde etmek için kaynama noktası sıcaklığı daha yüksek olmalıdır. Bir çözeltiye uçucu olmayan bir çözünen eklemek bu çözeltinin kaynama noktasını yükseltir.
Bir çözücü bir çözücü içinde çözündüğünde, çözeltinin kaynama noktası denkleme göre yükseltilir:
D T = i K b m
D T = sıcaklıktaki değişim
i = çözünmüş maddenin ayrıştığı parçacık sayısı olan van’t Hoff faktörü,
m = molalite, ki bu kilogram çözücü başına çözünen mol sayısı
K b = molal kaynama noktası sabiti ( su, K b = 0,5121 oC/m )
Donma Noktası Alçalması
Bu tartışmaya, normal donma noktasını tanımlayarak diğerlerini başlattığımız gibi başlayalım. Bir sıvının normal donma noktası, sıvının 1 atm’de katı hale geldiği sıcaklıktır. Donma noktasının daha spesifik bir tanımı, katı ve sıvı fazların dengede bir arada var olduğu sıcaklıktır. Bir çözüme çözücü eklediğimizde donma noktasının neden düşürüldüğünü anlayabildiğimizi görelim. Bir sıvıyı dondurmak için sıcaklığı düşürmemiz gerektiğini zaten biliyoruz. Sıcaklık düştükçe, katı faza doğru ilerledikçe çözelti daha düzenli hale gelir. Bu, termodinamiğin ikinci yasasına karşı çalışan bir etkidir. Kısacası, entropi (bozukluk), şeylerin doğal düzeninde azalmamayı sever. Bu yüzden, saf bir çözücüyü dondurmak için sıcaklığı belirli bir noktaya düşürmek zorunda kalırsak, bir çözünen eklediğimizde sistemin entropisine ekleriz. Karışım saf olandan daha düzensizdir. Sıvının fazları bir katı haline getirmesi için bu ek entropinin üstesinden gelinmesi gerekir. Bu, sıcaklığın öncekinden bile daha düşük olması gerektiği anlamına gelir. Bu nedenle, herhangi bir çözücüye herhangi bir çözünen madde ilave edilmesi, donma noktasını düşürecektir.
Kaynama noktası yükselmesinde olduğu gibi, sıcaklıktaki değişimin ne kadar büyük olacağını belirleyen denklem şu şekilde verilir:
D T = i K f m
D T = sıcaklıktaki değişim
i = çözünen maddenin ayrıştığı parçacık sayısı olan van’t Hoff faktörü,
m = molalite, ki bu kilogram çözücü başına çözünen mol sayısı
K f başına çözünen mol sayısıdır = molal donma noktası sabiti ( su, K f = – 1.86 oC/m )
Bir maddenin moleküler ağırlığını belirlemek için kolligatif özelliklerin kullanılması
Donma noktası alçalması veya kaynama noktası yükselmesi gibi bağlaşık özellikler, çözünür bir katının moleküler ağırlığını hesaplamak için kullanılabilir. Bu hesaplamayı tamamlamak için, çözünen maddenin ve çözücünün kütlesinin yanı sıra saf çözücünün ve çözeltinin donma noktaları / kaynama noktaları da bilinmelidir.
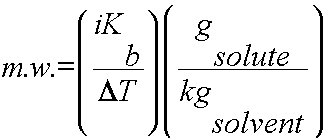 veya
veya 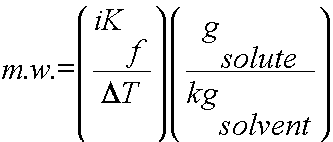
İzlenecek adımlar şunlardır:
1) DT’yi belirleyin.
2) DT, i ve Kb veya Kf ‘yi çözünen maddenin molalitesini belirlemek için kullanın. (m = g çözünen / kg çözücü )
3) Tüm değerleri yerine koyun ve mw ‘yi hesaplayın.
4) Hesaplanan değerinizin makul olup olmadığını değerlendirmek için sağduyunuzu kullanın! Hata olup olmadığını kontrol edin.
Moleküler ağırlığı hesaplamak için buhar basıncı değişikliğini veya ozmozu da aynı şekilde kullanabilirsiniz.
Kaynaklar:
https://www.chem.fsu.edu/chemlab/chm1046course/colligative.html

